这是一个复杂且多因素相互作用的过程,可以简单概括为:在遗传易感性的基础上,由环境因素(如感染)触发,导致免疫系统功能紊乱,产生大量自身抗体和炎症因子,最终攻击自身的关节滑膜,引发慢性、破坏性的炎症。
(图片来源网络,侵删)
下面我们将其分解为几个关键步骤和核心要素进行详细说明。
核心病理过程:从“滑膜炎”到“关节破坏”
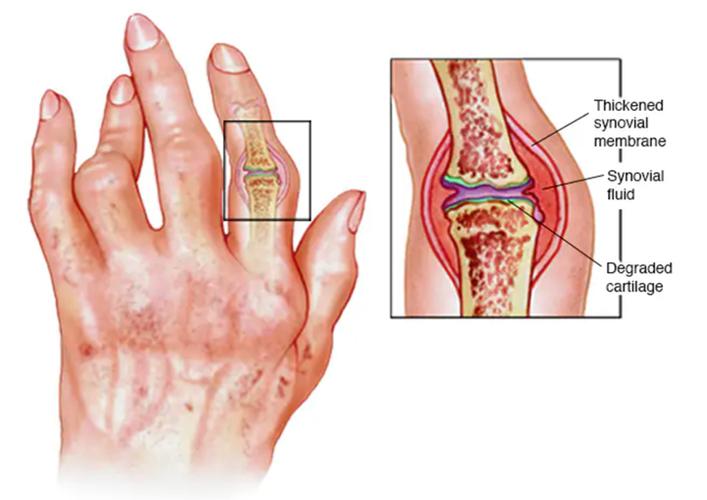
RA的根本病变发生在关节的滑膜,滑膜是关节腔内一层薄薄的膜,负责分泌滑液以润滑关节,在RA中,正常的滑膜被异常激活,转变为一种侵袭性的、类似肿瘤的组织,称为“血管翳”(Pannus),这个血管翳是导致关节破坏的“元凶”。
整个发病机制可以分为以下几个阶段:
第一阶段:启动与触发
-
遗传易感性:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 核心基因: HLA-DR4 和 HLA-DR1 是RA最重要的遗传风险基因,它们属于人类白细胞抗原家族,主要负责向T细胞“呈递”抗原,启动免疫反应。
- 作用机制: 携有这些易感基因的人,其HLA分子更容易结合并呈递某些特定的自身抗原(如瓜化蛋白),从而错误地激活免疫系统,将其识别为“敌人”,这就像一把“锁”,只有特定形状的“钥匙”(自身抗原)才能打开,导致错误启动。
- 其他基因: 除了HLA,还有数十个非HLA基因(如PTPN22、STAT4等)也被证实与RA相关,它们共同构成了遗传背景,增加了个体患病的风险。
-
环境触发因素:
- 感染: 这是目前最受关注的触发因素,虽然RA不是由单一感染引起的,但某些病原体(如EB病毒、牙周致病菌(如牙龈卟啉单胞菌)、细小病毒B19等)可能扮演了“扳机”的角色。
- 分子模拟: 一种理论认为,这些病原体的某些蛋白片段与人体自身的蛋白(如瓜化蛋白)结构非常相似,免疫系统在清除外来病原体后,可能会“记错”,转而攻击结构相似的自身组织,这就是“交叉反应”。
- 其他因素: 吸烟是RA最强的环境危险因素之一,它不仅会增加患病风险,还会加重病情,激素水平、肠道菌群失调等也可能参与其中。
第二阶段:免疫系统的紊乱与激活
这是RA发病的核心环节,涉及多种免疫细胞和分子的协同作战。
-
自身抗原的产生:
- 在遗传和环境因素的共同作用下,关节内的细胞(如成纤维细胞、巨噬细胞)可能发生应激或死亡,释放出一些正常情况下被隐藏的蛋白质,即自身抗原。
- 最重要的自身抗原是“瓜化蛋白”(瓜氨酸化蛋白),蛋白质在翻译后修饰过程中,精氨酸被转化为瓜氨酸,这种改变使其成为免疫系统攻击的“新靶点”,抗瓜化蛋白抗体是RA的标志性抗体之一。
-
抗原呈递与T细胞活化:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 树突状细胞等抗原呈递细胞吞噬这些自身抗原,并将其处理成小片段。
- 这些片段通过HLA-DR4/1分子呈递给CD4+ T辅助细胞。
- T细胞受体识别并结合了这个“自身抗原-HLA复合物”,并被完全激活,这是免疫反应错误启动的关键一步。
-
“细胞风暴”:多种免疫细胞的协同攻击:
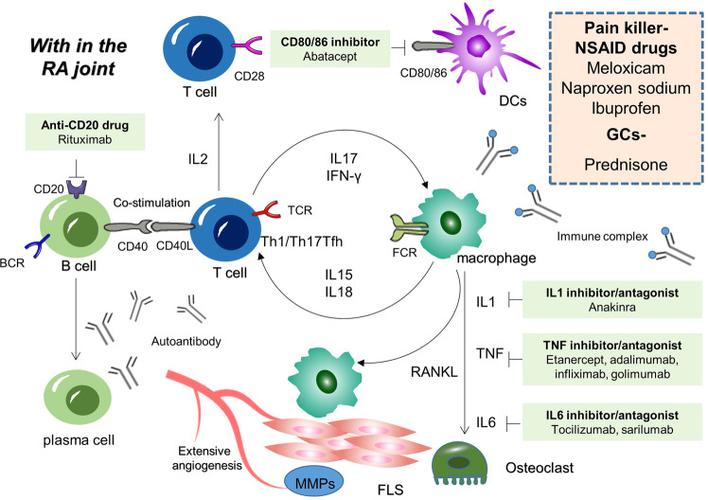
- 活化的T细胞: 成为“指挥中心”,分泌大量细胞因子(如TNF-α, IL-1, IL-6, IL-17),招募并激活其他免疫细胞。
- B细胞: 在T细胞的帮助下被激活,分化为浆细胞,大量产生自身抗体,这些抗体包括:
- 类风湿因子: 针对自身IgG抗体的抗体,是RA最早发现的标志物。
- 抗环瓜氨酸肽抗体: 特异性极高,对RA的诊断和预后判断有重要意义。
- 巨噬细胞: 被T细胞因子激活,成为“炎症工厂”,大量释放TNF-α, IL-1, IL-6等促炎因子。
- 成纤维样滑膜细胞: 这些细胞在炎症因子的刺激下被“癌变”,异常增殖,失去接触抑制,具有极强的侵袭性,是形成“血管翳”的主要细胞。
第三阶段:效应阶段——炎症与破坏
被激活的免疫系统和炎症因子最终将矛头指向关节,造成一系列破坏性后果。
-
滑膜炎与血管翳形成:
- 大量的炎症因子(TNF-α, IL-1, IL-6)导致滑膜充血、水肿、增生。
- 活化的成纤维样滑膜细胞与浸润的免疫细胞、新生血管一起,形成一层侵袭性的“血管翳”。
-
关节破坏:
- 血管翳的侵袭: 血管翳会覆盖并侵蚀关节软骨,像“苔藓”一样逐渐将其破坏。
- 骨侵蚀: 血管翳中的细胞(如破骨细胞前体)在炎症因子的刺激下,被激活为破骨细胞,开始溶解和破坏关节下方的骨质,形成“骨侵蚀”,这是RA导致关节畸形和功能丧失的直接原因。
- 滑膜液改变: 关节腔内充满大量炎症细胞、炎性蛋白和抗体,导致滑液变得粘稠浑浊,进一步损害关节软骨。
-
系统性表现:
- 由于炎症因子(尤其是TNF-α, IL-6)会进入血液循环,RA不仅影响关节,还会引起全身性症状,如:
- 全身症状: 发热、乏力、体重下降、食欲不振。
- 关节外表现: 类风湿结节(血管翳在皮肤下的表现)、血管炎、间质性肺炎、心脏炎、血液系统异常(如贫血)等。
- 由于炎症因子(尤其是TNF-α, IL-6)会进入血液循环,RA不仅影响关节,还会引起全身性症状,如:
发病机制示意图
遗传易感性 (HLA-DR4/1等) + 环境触发 (感染、吸烟等) 免疫系统紊乱 (产生自身抗原,如瓜化蛋白) 抗原呈递 → T细胞活化 “细胞风暴”
- T细胞 → 分泌大量炎症因子 (TNF-α, IL-1, IL-6, IL-17)
- B细胞 → 产生自身抗体 (RF, ACPA)
- 巨噬细胞/FLS → 释放炎症因子,增殖侵袭 效应阶段
- 滑膜增生 → 形成血管翳
- 血管翳侵袭 → 破坏关节软骨和骨质
- 炎症因子入血 → 引起全身症状 临床结局:慢性关节炎、关节畸形、功能障碍、系统性损害
治疗机制的启示
理解了RA的发病机制,我们就能明白现代靶向治疗的原理:
- 靶向TNF-α (如依那西普、阿达木单抗):中和体内最关键的炎症因子之一,直接阻断炎症级联反应。
- 靶向IL-6受体 (如托珠单抗):阻断IL-6的信号通路,减轻炎症和全身症状。
- 靶向B细胞 (如利妥昔单抗):清除产生自身抗体的B细胞,从源头上减少抗体产生。
- 靶向T细胞共刺激信号 (如阿巴西普):阻止T细胞的完全活化,打断免疫指挥中心。
RA的发病机制是一个由遗传、环境、免疫和炎症等多个环节构成的复杂网络,虽然目前尚无法根治,但对其机制的深刻认识已经极大地推动了诊断和治疗技术的进步,使许多患者能够达到临床缓解或低疾病活动度状态。




